Ο κ. Φαρσαλινός σε ανάρτησή του στο Twitter στις 27/7/2021 γράφει:
«Για να το κάνω απλό: το PCR ελέγχει συγκεκριμένα γονίδια του SARS–CoV-2, που δεν έχουν καμία σχέση με τα γονίδια του ιού της γρίπης. Δεν μπορεί να τα μπερδέψει».
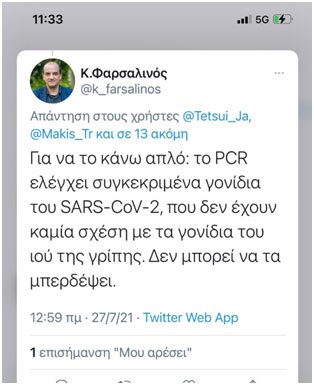
Σε σχέση μ’ αυτό, με όλη την εκτίμηση που του έχω, ας μου επιτραπεί να αντικρούσω την άποψή του, σημειώνοντας ότι τα Τεστ-PCR «μπέρδευαν» εξ αντικειμένου και εκ κατασκευής τους ιούς SARS–Cov-2 με τους ιούς της γρίπης (και όχι μόνο μ’ αυτούς) όπως προκύπτει και από την επίμαχη πρόσφατη ανακοίνωση των CDC, για την απόσυρσή τους:
«Μετά τις 31 Δεκεμβρίου 2021, τα CDC θα αποσύρουν το αίτημά τους προς την Αμερικανική Υπηρεσία Τροφίμων και Φαρμάκων (FDA) για εξουσιοδότηση άδειας χρήσης έκτακτης ανάγκης (EUA) του 2019-Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel, που παρουσιάστηκε για πρώτη φορά τον Φεβρουάριο του 2020 μόνο για την ανίχνευση του SARS-CoV-2. Τα CDC ειδοποιούν εκ των προτέρων τα κλινικά εργαστήρια ώστε να έχουν επαρκή χρόνο για να επιλέξουν και να εφαρμόσουν μία από τις πολλές εναλλακτικές λύσεις που έχουν εγκριθεί από την FDA.
»Επισκεφτείτε τον ιστότοπο της FDA για μια λίστα διαγνωστικών μεθόδων για την COVID-19, εγκεκριμένων από την FDA. Για μια σύνοψη της απόδοσης των μοριακών μεθόδων που έχουν εγκριθεί από την FDA»: πίνακας αναφοράς FDA, στην ιστοσελίδα.
Για την προετοιμασία αυτής της αλλαγής, τα CDC συνιστούν στα κλινικά εργαστήρια και τους ιστότοπους δοκιμών που χρησιμοποιούν το τεστ CDC 2019-nCoV RT-PCR να επιλέξουν και να ξεκινήσουν τη μετάβασή τους σε ένα άλλο τεστ COVID-19 που είναι εγκεκριμένο από την FDA.
Τα CDC συνιστούν στα εργαστήρια να εξετάσουν το ενδεχόμενο να υιοθετήσουν μια πολυπλεγμένη μέθοδο που να μπορεί να διευκολύνει την ανίχνευση και διαφοροποίηση των ιών SARS–CoV-2 και της γρίπης.
[Παρατήρηση: Δηλαδή, μέχρι τώρα ΔΕΝ ΕΙΧΑΝ ΤΗ ΔΥΝΑΤΟΤΗΤΑ ΔΙΑΚΡΙΣΗΣ ΜΕΤΑΞΥ ΙΟΥ COVID ΚΑΙ ΙΩΝ ΤΗΣ ΓΡΙΠΗΣ. Αν την είχαν, δεν θα χρειαζόταν η -άκρως αποκαλυπτική- ΑΠΟΣΥΡΣΗ]
«Τέτοιοι προσδιορισμοί μπορούν να διευκολύνουν τις συνεχείς δοκιμές τόσο για τη γρίπη όσο και για το SARS-CoV-2 και μπορούν να εξοικονομήσουν χρόνο και πόρους καθώς κατευθυνόμαστε στην εποχή της γρίπης. Τα εργαστήρια και οι χώροι δοκιμών πρέπει να επικυρώσουν και να επαληθεύσουν τον επιλεγμένο προσδιορισμό εντός της εγκατάστασής τους πριν ξεκινήσουν τις κλινικές δοκιμές».
[Παρατήρηση: ΚΑΙ ΠΡΟΤΡΕΠΕΙ ΤΑ ΕΡΓΑΣΤΗΡΙΑ (ΜΕ LINK) ΝΑ ΔΙΑΛΕΞΟΥΝ ΕΝΑ ΑΠΟ ΤΑ 179 ΤΕΣΤ ΣΤΑ ΟΠΟΙΑ ΧΟΡΗΓΗΣΕ Η FDA ΑΔΕΙΑ ΧΡΗΣΗΣ ΕΚΤΑΚΤΗΣ ΑΝΑΓΚΗΣ (EUA). EUA ΣΕ… ΟΛΑ.]
ΤΟ ΑΓΓΛΙΚΟ ΚΕΙΜΕΝΟ:
«After December 31, 2021, CDC will withdraw the requestto the U.S. Food and Drug Administration (FDA) for Emergency Use Authorization (EUA) of the CDC 2019-Novel Coronavirus (2019-nCoV) Real-Time RT-PCR Diagnostic Panel, the assay first introduced in February 2020 for detection of SARS-CoV-2 only. CDC is providing this advance notice for clinical laboratories to have adequate time to select and implement one of the many FDA-authorized alternatives.
»Visit the FDA website for a list of authorized COVID-19 diagnostic methods. For a summary of the performance of FDA-authorized molecular methods with an FDA reference panel, visit this page.
»In preparation for this change, CDC recommends clinical laboratories and testing sites that have been using the CDC 2019-nCoV RT-PCR assay select and begin their transition to another FDA-authorized COVID-19 test. CDC encourages laboratories to consider adoption of a multiplexed method that can facilitate detection and differentiation of SARS-CoV-2 and influenza viruses. Such assays can facilitate continued testing for both influenza and SARS-CoV-2 and can save both time and resources as we head into influenza season. Laboratories and testing sites should validate and verify their selected assay within their facility before beginning clinical testing».
zougla.gr
Επιλεξτε να γινετε οι πρωτοι που θα εχετε προσβαση στην Πληροφορια του Stranger Voice





